- Detalhes
- Categoria: Legislação Farmacêutica
- By fabio
 A Agência Nacional de Vigilância Sanitária (Anvisa) realiza, na próxima quarta-feira (23/2/2011), audiência pública para discutir o cancelamento do registro dos medicamentos que contém sibutramina e dos anorexígenos anfetamínicos (anfepramona, femproporex e mazindol). Os produtos à base dessas quatro substâncias atuam como inibidores de apetite e devem ser retirados do mercado brasileiro devido aos altos riscos à saúde que podem acarretar.
A Agência Nacional de Vigilância Sanitária (Anvisa) realiza, na próxima quarta-feira (23/2/2011), audiência pública para discutir o cancelamento do registro dos medicamentos que contém sibutramina e dos anorexígenos anfetamínicos (anfepramona, femproporex e mazindol). Os produtos à base dessas quatro substâncias atuam como inibidores de apetite e devem ser retirados do mercado brasileiro devido aos altos riscos à saúde que podem acarretar.
A indicação da Anvisa está baseada em estudos científicos e no parecer da Câmara Técnica de Medicamentos (Cateme) de 26 de outubro de 2010. No documento, o órgão recomenda o cancelamento dos medicamentos por apresentarem riscos que superam seus benefícios.
Segundo nota técnica da área de Farmacovigilância e da gerência de Medicamentos da Anvisa, a sibutramina apresenta baixo coeficiente de efetividade de redução de peso e pouca manutenção de redução de peso em longo prazo. Além disso, estudos indicam possível aumento de risco cardiovascular entre todos os usuários.
Os medicamentos anorexígenos anfepramona, femproporex e mazindol, por sua vez, apresentam graves riscos cardiopulmonares e do sistema nervoso central. Esses fatores tornam insustentável a permanência destes produtos no mercado, mesmo considerando as melhorias já implantadas no processo de controle da venda destes medicamentos no Brasil.
A nota técnica da Anvisa destaca, ainda, que esses medicamentos não são comercializados em diversos países desenvolvidos por serem considerados medicamentos obsoletos e de elevado risco aos usuários.
- Confira a Nota Técnica Sobre a Eficácia e Segurança dos Medicamentos Inibidores de Apetite
Cenário atual da venda dos medicamentos
Inibidores de Apetite no Brasil
Medicamentos tipo anfetamínicos
Os medicamentos anfepramona, femproporex e mazindol estão no mercado brasileiro há mais de 30 anos. Como anorexígenos, deveriam ser indicados apenas como coadjuvantes ao tratamento da obesidade, que inclui restrição calórica,
exercícios e modificação do comportamento.
No entanto, por serem estimulantes, esses produtos têm sido desviados de seu uso clínico para uso recreacional e para doping em esportes. O acompanhamento da Anvisa tem demostrado, também, que existe grande potencial de uso abusivo dessas
substâncias , apesar das inúmeras advertências sobre seus riscos.
“Não existem evidências científicas sobre o valor da utilização dessas substâncias em longo prazo. Seu consumo elevado no Brasil pode demonstrar que suas indicações clínicas e seu acesso, em farmácias de manipulação e drogarias, estão muito
distantes das preconizadas pela Organização Mundial da Saúde e pelos órgãos sanitários”, explica o diretor-presidente em exercício da Anvisa, Dirceu Barbano.
No final dos anos 1960, uma epidemia de Hipertensão pulmonar primária (HPP) ocorreu na Europa, após a introdução de um anorexígeno denominado fumarato de aminorex. A partir desse achado, foi também documentada a associação entre
desenvolvimento de HPP e uso de fenfluramina e dexfenfluramina. Com isso, muitos países determinaram a retirada do produto do mercado.
Após a associação dos medicamentos anfetamínicos com HPP, outros medicamentos anorexígenos passaram a ser questionados quando a segurança pulmonar e outros riscos. Por isso, a maioria dos países desenvolvidos não registra medicamentos tipo anfetamínicos (como anfepramona, femproporex e mazindol) há muitos anos.
Sibutramina
A sibutramina recebeu seu registro no Brasil em março de 2008. O medicamento atua como inibidor seletivo da recaptação da Serotonina, promovendo o aumento da saciedade no paciente.
A partir de suspeitas relativas ao risco cardiovascular, a Agência Europeia de Medicamentos (EMA) solicitou ao fabricante Abbott um estudo em que fosse avaliado o risco da sibutramina entre os usuários obesos que apresentavam um risco prévio
cardiovascular. O estudo, denominado SCOUT, durou 6 anos, e seu relatório final foi publicado em setembro de 2010, no New England Journal of Medicine.
Entre as conclusões do artigo, destacam-se:
- apenas 30,4% dos pacientes tratados com sibutramina perderam pelo menos 5% do seu peso corporal em 3 meses;
- aumento de eventos adversos não fatais cardiovasculares nos pacientes tratados com
sibutramina com conhecida doença cardiovascular subjacente (diagnosticada por médico);
- 16% de aumento do risco CV (como Infarto Agudo do Miocárdio e Acidente Vascular Cerebral) entre usuários de sibutramina (p=0,016).
Em janeiro de 2010, a EMA determinou o cancelamento do registro da sibutramina na Europa devido aos riscos cardiovasculares demonstrados pelo estudo SCOUT. O FDA (Food and Drug Administration), em outubro de 2010, anunciou que a empresa retiraria voluntariamente a sibutramina dos Estados Unidos. A mesma medida foi tomada no Canadá e Austrália.
No Brasil, em março de 2010, a Anvisa alterou a forma de controle da sibutramina, remanejando a substância da lista C1 para a Lista B2 dos medicamentos sujeitos à controle especial (Portaria 344/98).
Com a mudança, a sibutramina passou a ser classificada como psicotrópico anorexígeno e a tarja do medicamento mudou de vermelha para preta. A nova norma passou a exigir, também, que esses medicamentos sejam vendidos com receituário
azul (em que a numeração é fornecida pela vigilância sanitária). Até então, a sibutramina era comercializada com receita branca, que não é numerada pela autoridade sanitária.
No dia 1º de julho, a Anvisa publicou, também, a RDC no 25/2010 que estabeleceu a Dosagem Diária Máxima de 15 mg para a sibutramina, visando a promoção do uso seguro e racional do produto.
Notícias sobre a Sibrutamina publicadas em 2010:
Em Janeiro de 2010 a Anvisa publicou o alerta sobre uso da sibutramina para profissionais de saúde.
Em fevereiro de 2010 o CFF publicou Nota Técnica sobre sibutramina
Dados de Consumo no Brasil
Em 2007, após introdução do Sistema Nacional de Gerenciamento de Produtos Controlados (SNGPC) foi identificado que, entre os produtos controlados pela Portaria 344/98, os medicamentos mais consumidos foram: anfepramona (3 toneladas),
sibutramina (1,8 tonelada), femproporex (1,04 tonelada) e mazindol (2 kg).
Os dados são relativos às informações repassadas por 38.500 estabelecimentos farmacêuticos, cerca de 62% da rede privada do país no ano de 2007.
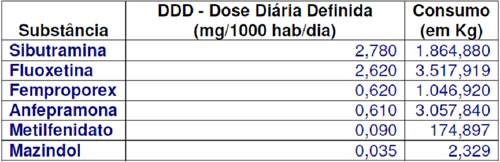
Em março de 2010, a Anvisa divulgou novo relatório do SNGPC, relativo ao ano de 2009. Os dados podem ser vistos na tabela 1.
Tabela1: Consumo de medicamentos anorexígenos e outros medicamento
Audiência Pública para discutir proposta de retirada dos inibidores de apetite
Quando: quarta-feira (23/2/2011); de 9h às 13h.
Onde: Auditório da Anvisa (SIA trecho 5, área especial 57, bloco E).
Fonte: ANVISA













